Les propriétés de la molécule d'eau
|
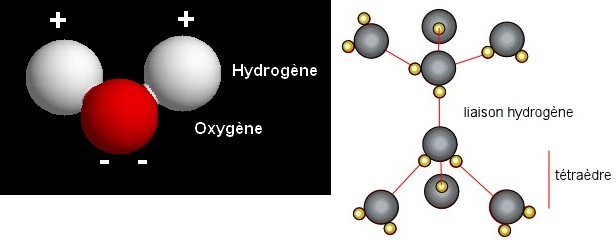
Les molécules d'eau sont chargées électriquement et se comportent comme des dipôles. Cette propriét est dûe à la liaison covalente asymétrique qui unit les atomes d'hydrogène à l'oxygène. Ainsi, les deux atomes d'hydrogène sont placés d'un seul côté et engendrent une faible charge. La nature polaire de la molécule d'eau permet l'établissement de liaisons hydrogène entre les molécules qui se disposent alors en groupes tétraédriques. Les propriétés de l'eau dcoulent de cette structure : - L'eau est un très bon solvant car les extrémités positives ou négatives de la molécule peuvent s'attacher aux cations ou aux anions ; - Le groupement des molcules d'eau en tétraèdres explique la forte tension superficielle et la capillarité ; De plus, les molécules d'eau s'ionisent en H+ et OH-. A la température ordinaire, il y a seulement 10-7 moles par litre d'ions hydrogène (et autant de OH-) dans l'eau pure : le pH est donc de 7. L'apport d'ions hydrogène diminue le pH : cette acidité est produite notamment par le CO2 et les acides humiques du sol. H2O + CO2 -----> H2CO3 -----> H+ + (HCO3)- |
Source : Bibliothèque de molécules, Imperial College de Londres Source : Cours J. Beauchamp - Univ. de Picardie
|