TP salinité mohr
TP Déterminons la salinité d'une eau par la méthode de Mohr
Principe : Nous allons effectuer le dosage (ou titrage) des ions chlorure Cl- par les ions argent Ag+, ce qui nous permettra de déterminer la chlorinité d'une eau et donc de calculer sa salinité.
Limite de la méthode de Mohr :
En milieu basique (pH > 7,5) une partie des ions Ag+(aq) est consommée par une réaction parasite de précipitation qui forme AgOH(s). Cette méthode ne peut donc pas être utilisée en milieu basique avec pH >7,5.
En milieu acide (pH < 6,5), le précipité de chromate d’argent Ag2CrO4(s) qui est un indicateur de fin de réaction est soluble : on ne peut donc plus repérer l’équivalence du dosage par apparition du précipité rouge brique. Cette méthode ne peut donc pas être utilisée en milieu acide avec pH <6,5.
Le domaine de pH pour lequel on peut utiliser la méthode de Mohr est restreint au domaine : 6,5 < pH < 7,5
Matériel :
Tubes à essais + porte-tube ; Pipettes PVC ; 2 Béchers de 100 mL ; 1 erlenmeyer de 250 mL ; 1 pipette jaugée de volume V1 (volume correspondant à la prise d'essai) + propipette.
Burette graduée de 25 mL ; Support pour burette ; Agitateur magnétique + barreau aimanté ;
Solution de nitrate d'argent à 0,025 mol.L-1; Solution de chromate de potassium à 50 g.L-1 ; Solution de chlorure de sodium à 3 g.L-1.
Expériences préalables :
- Dans deux tubes à essais, introduire 3 mL de solution de nitrate d'argent (Ag+ + NO3-). Ajouter, dans le premier tube, quelques gouttes de la solution de chlorure de sodium (Na+ + Cl-) et, dans le second, quelques gouttes de la solution de chromate de potassium (2K+ + CrO42-). Qu'observe-t-on ?
Dans le tube 2, il se forme un précipité rouge brique de chromate d'argent : 2Ag+(aq) + CrO42-(aq) -> Ag2CrO4(s) (2)
- Dans un tube à essais, introduire 2 mL de solution de chlorure de sodium et 2 mL de solution de chromate de potassium. Puis, ajouter goutte à goutte avec une pipette, la solution de nitrate d'argent. Comment les deux précipités apparaissent-ils ?
Les deux précipitations ne sont pas simultanées mais successives. On observe d'abord la précipitation du chlorure d'argent puis lorsque cette transformation est achevée et que les ions chlorure ont disparus, celle du chromate d'argent.
Réalisation du dosage :
On commencera par faire un titrage rapide pour repérer l'ordre de grandeur de l'équivalence puis un titrate plus précis pour déterminer le volume équivalent Veq.
- Verser, à l'aide la pipette jaugée, un volume V1 d'eau dans le bécher et ajouter 2 mL de solution de chromate de potassium dans le bécher (la solution à titrer doit devenir jaune). Remplir la burette avec la solution titrante de nitrate d'argent de concentration C2 et ajuster le zéro (ôter toute bulle d'air). Faire couler la solution titrante dans le bécher mL par mL pour repérer grossièrement l'équivalence Veq.
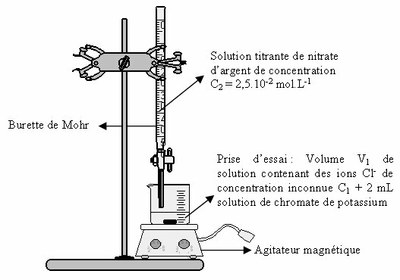
- Refaire le titrage en versant un volume (Veq - 1 mL) de solution titrante puis cette solution goutte à goutte jusqu'à l'apparition de la couleur rouge. Noter le volume équivalent Veq.
Questions :
- Quelle est la réaction de titrage ? C'est la réaction de précipitation Ag+(aq) + Cl-(aq) -> AgCl(s) (1).
- Lorsque la quantité d'ions argent versée est égale à la quantité d'ion chlorure présents dans la prise d'éssai, on a atteint l'équivalence du dosage. Quelle est le réactif en excès avant l'équivalence ? Avant l'équivalence, il reste des ions Cl- en solution. Les ions Ag+ versés sont consommés (en priorité) par la réaction (1) avec les ions Cl-.
- Quel est le réactif en excès après l'équivalence ? Après l'équivalence, il ne reste plus d'ions Cl- en solution. Les ions argent Ag+ constituent le réactif en excès.
- Avec quels ions, le réactif en excès réagit-il ? Les ions argent Ag+ versés en excès réagissent avec les ions chromate CrO42- pour produire le précipité rouge de chromate d'argent Ag2CrO4 (réaction (2)).
- Quel est l'indicateur de fin de dosage ? L'apparition de la couleur rouge brique marque la fin du dosage des ions Cl- par les ions Ag+ : c'est l'indicateur de la fin de la réaction de titrage.
Exploitation du dosage :
- Déterminer la concentration molaire C1 des ions chlorure dans l'eau. A l'équivalence, les réactifs ont été versés dans les proportions stoechiométriques donc : n (Cl-) = n (Ag+)eq d'où C1 x V1 = C2 x Veq. On obtient donc : C1 = C2 x Veq/V1 = .... mol.L-1
- On donne les masses molaires suivantes : M(Na) = 23 g/mol et M(Cl) = 35,5 g/mol. En déduire la concentration massique en ions chlorure de cette eau. Cm = C1 x M(Cl) = .... g.L-1.
- Déterminer la densité de l'eau de mer (par exemple par pesée de 100 mL d'eau ou avec un densimètre) : d = ......
- En déduire la chlorinité de cette eau (c'est la masse en g de chlorures dans 1 kg d'eau de mer). Cl = Cm / d = ..... g par kg d'eau de mer
- En déduire la salinité de cette eau. S = 1,80655 x Cl = .... g par kg d'eau de mer (salinité absolue)
Quelques remarques pratiques :
- La solution de nitrate d'argent ne se conservant pas très bien, il sera peut-être nécessaire de déterminer sa concentration molaire en effectuant un titrage préalable avec une solution de chlorure de sodium de concentration connue.
- Si l'eau testée est de l'eau de mer, il sera peut-être nécessaire de procéder à une dilution avant de réaliser le dosage.
- Pour de l'eau du robinet, le volume V1 de la prise d'essai sera de 250 mL (utiliser une éprouvette graduée pour prélever ce volume et le verser dans l'erlenmeyer).
- Pour de l'eau minérale, le volume V1 de la prise d'essai sera de 20 mL (à prélever à la pipette jaugée).


